La Alquimia dejó de ser Alquimia, para pasar a ser Química, gracias a científicos como Lavoisier, Dalton, Berthollet, Avogadro o la persona que nos ocupa aquí: Louis Proust. Joseph Louis Proust (1754-1826) farmacéutico y químico francés desarrolló la mayor parte de su actividad científica y profesional en España como profesor de química y metalurgia en el Real Colegio de Artillería de Segovia, dentro del complejo del Alcázar. En su laboratorio, magníficamente dotado con los mejores medios de la época, estableció uno de los grandes pilares de la Química, la Ley de las Proporciones Definidas, también conocida en homenaje a su descubridor como Ley de Proust. A la luz de esa ley Proust investigó extensamente sobre la mejor composición para la pólvora. En este artículo se desvela la «fórmula perfecta» que Proust encontró usando por primera vez el método científico. Esta formulación era la que se usaba en la Fábrica de Pólvoras de El Fargue.
La persona
Joseph Louis Proust nació en Angers, Francia, el 26 de septiembre de 1754 y murió en la misma ciudad en 1826. Sus primeros conocimientos de química y herboristería los recibió en la farmacia de su padre en la que trabajaba. Con veintiún años ganó las oposiciones de Farmacéutico Jefe del Hospital de la Salpétrière en París. Durante su estancia en París conoció a Lavoisier con quien estableció amistad. Esto supuso una gran oportunidad para Proust, ya que conoció de primera mano la construcción del edificio de la Química y la ruina de la vieja Alquimia. Lavoisier es considerado «el padre de la Química», y Proust será uno de sus seguidores más avanzado y brillante.

En 1786, por un acuerdo entre el Rey de España Carlos III y el Rey de Francia Luis XVI, Louis Proust es contratado, a propuesta de Lavoisier, como profesor de química en Madrid. Al poco es trasladado para enseñar química y metalurgia en en el Real Colegio de Artillería de Segovia. Esta institución, fundada por Carlos III, se estableció en el Alcázar de Segovia, antiguo castillo y palacio residencia de los monarcas del Reino de Castilla. Aquí da Proust cursos a los cadetes de artillería y realiza en su muy bien dotado laboratorio numerosas investigaciones en química.


Además de la docencia en química y sus investigaciones en el laboratorio, Proust fue uno de los precursores de los vuelos aerostáticos. Todavía en su estancia en París, y por su amistad con el farmacéutico Pilâtre de Rozier, pionero de la aerostación, participó en una ascensión en globo el 23 de junio de 1784 en presencia del rey Luis XVI de Francia y el rey Gustavo III de Suecia. Ya en España, en 1792 y tras varias pruebas en el Alcázar de Segovia, Proust hizo un vuelo de demostración en globo ante el Rey Carlos IV.
Aparte del establecimiento de la Ley de las Proporciones Definidas y de numerosos estudios sobre la pólvora negra de lo que nos ocuparemos a continuación, realizó investigaciones sobre el azúcar. Demostró que el azúcar de la uva y el azúcar de la miel son exactamente iguales: glucosa. Igualmente publicó los libros: «Indagaciones sobre el estañado de cobre, la vajilla de estaño y el vidriado» (1803) y «Memoire sur le sucre des raisins» (1808).
En 1806 viaja a Francia por motivos familiares pero ya no puede volver por cuestiones políticas resultantes de la invasión francesa de España. En su vuelta a Francia publica los resultados obtenidos en sus experimentos sobre diversas formulaciones de la pólvora negra y métodos de fabricación bajo el título de «Recueil des memoires relatifs a la poudre a canon» (1816) (Colección de memorias relacionadas con la pólvora)
Louis Proust fallece en su ciudad natal en el año de 1826.
La Ley de las Proporciones Definidas
Durante su estancia en el Alcázar de Segovia, Louis Proust realizó numerosos experimentos sobre la composición de distintos compuesto como los carbonatos de cobre, los óxidos de estaño y los sulfuros de hierro. Observó que para cada uno de estos compuestos, tras su análisis químico, los elementos entraban siempre en las mismas proporciones, independientemente de si la sustancia era de origen natural o sintetizada por cualquier método conocido. Así por ejemplo, en el caso del sulfuro de hierro, el azufre representaba el 63,6% del sulfuro y el hierro el 36,4%, y esto independientemente de que procediera de una fuente natural (la pirita) o se obtuviera sintéticamente mediante la acción directa en presencia de calor del azufre con el hierro, según la siguiente reacción:
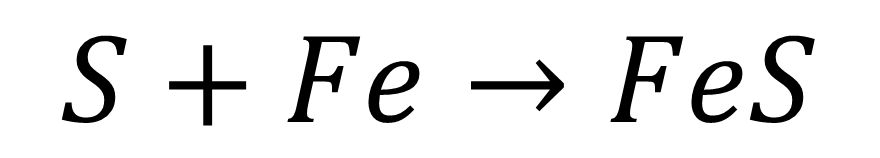
Así, si en la reacción anterior por cada 36,4 gramos de hierro se añaden más de 63,6 gramos de azufre de los necesarios, éstos no reaccionan y queda el exceso como residuo sin reaccionar. De forma análoga, si para una cantidad dada de azufre se añade más hierro del necesario, el hierro sobrante no reacciona y se queda mezclado con el sulfuro de hierro producido.
La Ley de las Proporciones Definidas o Ley de Proust dice que los elementos en los compuestos entran siempre en las mismas proporciones constantes y perfectamente definidas independientemente de su origen o método de síntesis.
Es obvio que si una sustancia no es totalmente pura, al analizarla pueden calcularse otras proporciones, pero ello es debido a la contaminación con otras sustancias extrañas. Este hecho provocó notables discusiones científicas entre Proust y Berthollet, otro importantísimo químico de la época y también uno de los padres de la Química moderna. Según Berthollet, los compuestos podían tener múltiples proporciones intermedias. La disputa se zanjó años después por la intervención de Berzelius, un médico y extraordinario químico sueco, que, con sus métodos analíticos muy depurados, se decantó por Proust.
No obstante la disputa, a Berthollet tampoco le faltaba parte de razón. Se sabe que hay ciertos compuestos que no forman moléculas independientes ni tampoco cristales con proporciones definidas, como es el caso de ciertos hidruros metálicos, en los que las proporciones de hidrógeno y de metal pueden ser variables. A estos compuestos se les denomina bertólidos, en honor a Berthollet.
La «fórmula perfecta» de la pólvora negra
Una vez establecida la Ley de las Proporciones Definidas, y las implicaciones que más arriba hemos citado sobre las reacciones químicas y las sustancias que quedan sin reaccionar como residuo porque se han adicionado en exceso, en cantidades superiores a las proporciones definidas, Proust se planteó encontrar las proporciones precisas y exactas de los componentes de la pólvora negra.
La pólvora se compone de salitre (nitrato potásico muy puro), carbón y azufre. Proust, en el laboratorio del Colegio de Artillería de Segovia, realizó numerosos experimentos para establecer las proporciones precisas de estos tres componentes para que al arder (reaccionar), no quedaran residuos de ningún componente sobrante, la pólvora ardiera con la máxima velocidad posible y tuviera la máxima potencia en su explosión. Fueron muchos los experimentos realizados, los cuales fueron publicados ya a su vuelta a Francia bajo la obra más arriba citada «Recueil des memoires relatifs a la poudre a canon» (1816) (Colección de memorias relacionadas con la pólvora)
La obra consta de un total de 9 memorias sobre los experimentos realizados. Las memorias fueron inicialmente publicadas de forma sucesiva en la revista «Journal de Physique, de Chimie et D’Histoire Naturelle» y luego recogidas en una sola obra. En cada una de las memorias va realizando experimentos y obteniendo conclusiones según el método científico, es decir, plantea distintas hipótesis y luego las comprueba empíricamente. Parte del hecho de que la pólvora al arder genera multitud de gases que en aquella época estaban muy mal definidos por la falta de medios analíticos adecuados. Ello dificultaba sobremanera la investigación.
Primeramente procede con mezclas binarias de salitre (nitrato potásico muy puro) con distintos tipos de carbones, sin incluir azufre. Estudia carbones obtenidos de muy diversas materias: azúcar, granos de maíz, de pino, de almidón, de clara de huevo, de cuero de vaca o incluso de sangre humana. Determina la velocidad de combustión de la pólvora resultane y los residuos de materiales que no han reaccionado con el objeto de identificar el mejor carbón para pólvoras. Aunque no hay grandes diferencias si el carbón es muy puro y muy finamente dividido, se decanta por el carbón procedente de quemar cáñamo, tal como se hacía en España tradicionalmente desde al menos el siglo XVI.
Una vez establecido el mejor carbón, hace ensayos sobre la relación óptima entre el salitre y el carbón que conduce a una mayor velocidad de la combustión y un menor residuo. En la tabla adjunta se muestran los resultados obtenidos por Proust y se observa que relaciones de salitre a carbón de 60 a 20 o de 60 a 30 son las que arden con mayor velocidad y dejan menor residuo. Los datos mostrados son para carbón de cáñamo y mezclas finamente divididas. Si las mezclas tienen un tamaño de grano mayor, la pólvora arde peor y deja más residuo, pero el óptimo se encuentra en las relaciones antedichas. Igualmente usando otros carbones, como el de pino, la pólvora arde más lentamente y deja más residuo, pero el óptimo sigue igualmente en las proporciones anteriores. También en esas proporciones se encuentra una altura de llama más elevada.

Con los medios analíticos limitados de la época, Proust piensa que los gases desprendidos contienen entre otros componentes desconocidos, y según la proporción de la mezcla, gas carbónico (CO2), monóxido de carbono (CO), ácido prúsico (cianuro de hidrógeno, HCN), amoniaco (NH3), gases nitrosos (NxOy) y nitrógeno (N2). Entre los residuos encuentra carbón sin reaccionar, nitritos, carbonato de potasio. Proust indica que un exceso de carbón, será por tanto y según la Ley de las Proporciones Definidas una carga que no aporta nada a la pólvora. Además el exceso hace que la pólvora se empaste mal en el proceso de fabricación en húmedo y posterior secado. En aplicaciones militares una pólvora que deje residuos es negativa para el ánima de los fusiles y los cañones que se ensuciaría inmediatamente. Considerando que la menor cantidad de carbón posible es lo más recomendable Proust establece que en pólvoras de salitre y carbón, pero sin azufre, el carbón debe estar en la proporción de 1/7 respecto del salitre.
Una vez establecida la fórmula de una pólvora sin azufre, Proust aborda la influencia de la introducción del azufre. Comprueba que el volumen de gases y por tanto la capacidad de expansión de la pólvora se incrementa con la adición de azufre. Eso sí, la adición de azufre implica disminución de la cantidad de carbón. También hace ensayos con morteros y comprueba que mejora la distancia alcanzada. Igualmente estudia la influencia de la humedad y el tiempo de molienda. Cuando se mezclan el salitre, el carbón y el azufre, para mezclarlos íntimamente se procede a molerlos previa humectación de la mezcla para evitar explosiones indeseables. Los ensayos demuestran que si se emplea una mezcla grosera, la pólvora es muy deficiente, pero conforme se muele, mejoran notablemente sus características hasta llegar a un tiempo máximo de molienda en que, por más que se continue, no se mejoran las características de la pólvora (ver tabla adjunta).

Tras todos los ensayos realizados siguiendo el método científico demuestra finalmente que la mejor fórmula de una pólvora negra se corresponde a la «dosificación antigua» que se empleaba en España y otros países pero que se dedujo en la antigüedad de forma intuitiva. Establece que:
- El carbón que da mejores resultados es el procedente de cáñamo. No obstante otros carbones muy puros en carbono dan también buenos resultados
- Una pólvora con azufre es mejor que una basada exclusivamente en salitre y carbón porque:
- Genera mayor volumen de gases.
- Genera menos residuos.
- Consigue mayor expansión y mayor alcance de proyectiles.
- La humedad y las condiciones de conservación son críticas.
- Un exceso de molienda de los componentes no conduce a un mejor producto.
La «formulación perfecta» es entonces la siguiente:
| Ingrediente | % |
| Salitre (Nitrato potásico) | 75,0 |
| Carbón (de cáñamo preferentemente) | 12,5 |
| Azufre | 12,5 |
Justificación moderna de la fórmula de la pólvora de Proust
En la época de Proust, con una ciencia química todavía en sus inicios ,los métodos analíticos y los conocimientos sobre reacciones químicas no permitían encontrar una justificación con una base teórica fuerte. Hoy día se sabe que cuando la pólvora negra se hace explosionar dentro de un recinto cerrado se alcanzan temperaturas entre 2500ºC y 3000 ºC con un desprendimiento unos 1300 J por gramo. En esas condiciones la reacción principal de la combustión de la pólvora (y que Proust desconocía) es:

Hoy día diremos que 2 moles de nitrato potásico reaccionan con 3 moles de carbono y 1 mol de azufre para dar 1 mol de sulfuro de potasio, 1 mol de nitrógeno y 3 moles de dióxido de carbono. A temperatura ambiente el nitrógeno y el dióxido de carbono son gases, pero a la temperatura de explosión de la pólvora (2500ºC-3000ºC) el sulfuro de potasio (K2S) se volatiliza también. Por tanto, si se cumple esta reacción, la pólvora no dejaría residuo alguno salvo las pequeñísimas cantidades que pudieran provenir de las impurezas de los componentes. Si pasamos de moles a gramos calculando los pesos moleculares respectivos, la estequiometría de la anterior reacción nos indica que: 202 gramos de nitrato potásico reaccionan con 36 gramos de carbono y 32 gramos de azufre. Pasando estos valores a %, se encuentra que la fórmula de la pólvora químicamente perfecta es:
- 75% de nitrato potásico
- 13% de carbono
- 12% de azufre
Para asegurar que no se forme nada de carbonato potásico, que podría dejar residuos (es una reacción colateral indeseable) se hace disminuir un poco la cantidad de carbón y aumentar la de azufre quedando exactamente la fórmula de Louis Proust: 75% de nitrato potásico, 12,5% de carbón y 12.5% de azufre.
Esta fórmula se estableció de manera científica en el laboratorio de la Escuela de Artillería de Segovia, es la que se usaba en la Fábrica de Pólvoras de el Fargue en Granada y que Proust denominaba «dosificación antigua»
Bibliografía recomendada
Louis Proust. Recueil des memoires relatifs a la poudre a canon. Paris (1816)
Fernando Ignacio de Prada Pérez de Azpeitia. Petardos, cohetes y mucha química. Consultado 15/03/2022.
Joaquín Alastrué Funes. Inventando la pólvora, fabricando la pólvora. El Fargue y la fábrica de Granada. Biblioteca de Temas Locales, Vol. 1. Diputación de Granada, Ed. Granada, 2016. https://www.amazon.es/Inventando-p%C3%B3lvora-fabricando-p%C3%B3lvora-f%C3%A1brica/dp/8478074007

