Se entiende por salitre mezclas de nitrato potásico, nitrato sódico y nitrato cálcico y otros nitratos. Para la pólvora se utiliza un salitre muy refinado consistente en nitrato potásico muy puro. En la actualidad el nitrato potásico se puede sintetizar a partir de nitrato sódico y cloruro potásico, pero en la antigüedad se obtenía a partir del salitre formado en las humedades de paredes y suelos en forma de eflorescencias, así como de mezclas de residuos vegetales, estiércol y orina. Ese salitre lo generan un conjunto de bacterias que se alimentan del nitrógeno atmosférico y del nitrógeno de la urea y del amoniaco presente en excrementos y orina, y materia orgánica en general.
Receta para obtener salitre de estiércol y orina
Para hacer pólvora se necesita un salitre muy puro que, como se indicado más arriba, consiste en nitrato potásico. En la actualidad se obtiene de forma sintética a partir del nitrato sódico, procedente de las minas salitreras como las del desierto de Atacama y zonas limítrofes o de ácido nítrico, y de cloruro potásico, también de minas como las de Suria en Cataluña (España). Pero en tiempos antiguos la obtención de salitre era un procedimiento difícil y de producción muy limitada. Básicamente se obtenía de eflorescencias en muros y suelos húmedos, o a partir de residuos orgánicos en putrefacción.

Una receta para obtener salitre de excrementos, residuos vegetales y orina puede ser como la que sigue:
- Sobre una superficie no porosa, para evitar lixiviación hacia abajo, se hace una pila consistente en una mezcla de estiércol de vaca, hojas y otro residuos de vegetales. También se pueden añadir cenizas de quemar hojas y ramas, preferentemente de cardo. La pila deberá tener una altura aproximada de unos 50 cm.
- Se tapa con una lona para crear un ambiente húmedo, pero que permita transpiración.
- Una vez a la semana se añade orina de vaca sobre la lona para que vaya penetrando a través de ella. Esto se repite durante unos tres o cuatro meses hasta que se vea que se forman eflorescencias cristalinas sobre esa lona. Esas eflorescencias son el salitre.
- Cuando la capa de salitre tenga unos 10 cm de espesor, se retira.
- El procedimiento se puede repetir hasta que ya no se produzca más salitre.

El estiércol se usa como fertilizante desde que se inventó la agricultura. La razón es muy sencilla: los excrementos de animales mezclados con paja y fermentados contienen mucho salitre en forma de nitrato potásico, y el nitrato potásico es un alimento esencial para el crecimiento de las plantas. La clave está en lo de «fermentado», ya que los excrementos usados directamente pueden no ser adecuados. La fermentación es el proceso que sufre el estiércol por la acción de bacterias que transforman la urea y el amoniaco de la orina y otros residuos nitrogenados en nitrato potásico, es decir, salitre.
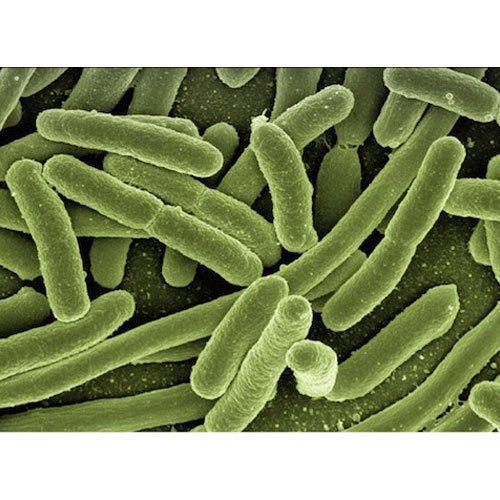
Las bacterias nitrificantes
Las bacterias nitrificantes son microorganismos que consiguen su energía oxidando el nitrógeno atmosférico y otras sustancias inorgánicas que lo contienen. Se encuentran frecuentemente en el medio ambiente en lugares húmedos donde hay concentraciones elevadas de amoniaco procedente de la descomposición de residuos orgánicos como proteínas, restos vegetales, excrementos y orina. Por ello es habitual ver salitre en corrales y cuadras. También en muros y suelos con humedades e incluso asociadas por simbiosis a las raíces de ciertos vegetales como las leguminosas.
Estas bacterias se dividen en dos grupos:
- Bacterias que oxidan el amoniaco, NH3, a nitritos, NO2–. Los géneros son:
- Nitrosomas: Se encuentran normalmente en el suelo, el alcantarillado, en agua dulce y en medios marinos. Son gram-negativas (es decir su pared celular es de naturaleza grasa), tienen forma de bastoncillos, son móviles gracias flagelos (con colas en forma de látigo para trasladarse) o no móviles.
- Nitrosococcus: Se encuentran en agua dulce y medios marinos. Tienen forma de de esferas (cocos) y móviles.
- Nitrosospira: Se encuentran en el suelo y tienen formas espirales y son móviles.
- Bacterias que oxidan los nitritos, NO2–, a nitratos, NO3–. Los géneros son:
- Nitrobacter: Se encuentran en el suelo, en agua dulce y medos marinos. Tienen forma de bastoncillos cortos, siendo móviles con flagelos o no móviles.
- Nitrospina: Sólo en medios marinos. Son grandes, en forma de bastoncillos delgados y no móviles.
- Nitrococcus: Solo en medios marinos. Cocci grande, con sistemas de membrana móvil con uno o dos flagelos subterminales.
- Nitrospira: Se encuentran en el suelo y en medios marinos. Las células helicoidales tienen forma vibroide. No son móviles.
El proceso se inicia con las bacterias que transforman el amoniaco a nitrito y luego actúan las que transforman el nitrito a nitrato.
Etapa 1: De amoniaco a nitrito.
NH3 + O2 → NO2– + 3H+ + 2e–
cuyo mecanismo tiene a su vez dos sub-etapas, una de oxidación del amoniaco, NH3, para dar hidroxilamina, NH2OH; la otra para transformar la hidroxilamina a nitrito, NO2–:
NH3 + O2 + 2H+ + 2e– → NH2OH + H2O
NH2OH + H2O → NO2– + 5H+ + 4e–
Etapa 2: De nitrito a amoniaco.
El mecanismo no se conoce bien, pero el resultado global es el de la oxidación del nitrito, NO2–, al nitrato, NO3–.
NO2– + H2O → NO3– + 2H+ + 2e–
Estos procesos biológicos realizado por las bacterias nitrificantes sobre materiales de origen orgánico ocurren en presencia de diversos cationes como K+, Na+, Mg2+ y Ca2+ entre otros. Ello conduce a que se obtenga un salitre consistente en una mezcla de nitratos:
- Nitrato potásico, KNO3 (el deseado para hacer pólvora)
- Nitrato sódico, NaNO3 (válido también para hacer pólvora, pero menos recomendable)
- Nitrato magnésico, Mg(NO3)2
- Nitrato cálcico, Ca(NO3)2 (Completamente indeseable para hacer pólvora)
Refinado del salitre
El salitre obtenido a partir de muros y suelos, y aún más el obtenido a partir de excrementos, orina y residuos vegetales, debe ser refinado para poder utilizarse en la fabricación de pólvora. El procedimiento tradicional incluía tediosos y repetidos procesos de filtrado, trasiegos, hervidos, recristalizaciones y secados. El objetivo era conseguir nitrato potásico muy puro, KNO4, y eliminar también cualquier traza de nitrato de calcio, Ca(NO3)2, que absorbe fácilmente el agua para dar su tetrahidrato:
Ca(NO3)2 + 4H2O → Ca(NO3)2·4H2O
Ese agua de cristalización puede liberarse con facilidad y provocar que la pólvora fabricada con salitre contaminado con nitrato cálcico se humedezca y pierda sus propiedades. En la imagen se muestra nitrato cálcico tetrahidratado. Se observa que consiste en cristales con aspecto «mojado» debido a su agua de cristalización.

El proceso de refinado del salitre será objeto específico de un nuevo artículo de la web.

Muy bien Rafa
Me gustaMe gusta
Enhorabuena!
Me gustaMe gusta
Muy buena informacion sobre el salitre y quienes lo producen: Las bacterias. y sobre todo como obtener salitre a partir del estiercol del ganado.
Me gustaMe gusta